2022-01-21 20:57:27
本文转载自公众号:药物开发Club
查询国家局送达信息栏,2021年11月18日在国家局药品信息送达栏发布了药品通知信息待领取信息,其中扬子江药业的布立西坦注射液未被批准:

布立西坦原研进口申报情况 |
我们来了解一下原研进口注册进口的情况,首先原研在2012年以布瓦西坦片为药品名称提交了临床申请,在2017年和2021年分别以布立西坦片提交了临床申请:
布立西坦片的临床试验备案,这里不包括BE试验,可以发现江西青峰药业进行了2个临床备案,江西青峰试验进展与原研UCB几乎同步,因此江西青峰原研之前批准上市是有可能的:
试验状态 | 适应症 | 试验通俗题目 | 申办单位 | |
CTR20210945 | 进行中 招募中 | 年龄≥16 岁伴或不伴继发全面性发作的部分性癫痫发作 | 一项评价布立西坦用作联合治疗在年龄≥16 岁伴或不伴继发全面性发作的部分性癫痫发作受试者中的安全性和有效性研究 | 江西青峰 |
CTR20210556 | 已完成 | 健康受试者 | 一项评价布立西坦在健康中国受试者中的药代动力学和安全性的研究 | UCB |
CTR20210190 | 进行中 尚未招募 | 治疗4岁及以上患者的部分性发作癫痫 | 布立西坦片单臂III期临床试验 | 江西青峰 |
CTR20202449 | 进行中 招募中 | 适用于成人及≥ 16 岁青少年癫痫患者伴有或不伴有继发性全面性发作的部分性发作的联合治疗 | 评价布立西坦联合治疗在有或无继发全面性发作的部分性癫痫发作受试者中的有效性和安全性 | UCB |
CTR20202124 | 进行中 尚未招募 | 治疗4岁及以上患者的部分性发作癫痫。 | 布立西坦片/安慰剂对照III 期临床试验 | UCB |
根据UCB和江西青峰临床备案和进展来看,江西青峰是比较主动的,是唯一有可能在原研上市之前获得批准的仿制药,江西青峰通过做临床获得提前上市,提前布局市场获得收益覆盖掉临床投入,那么江西青峰就是赚的,其他几家仿制药企业想要先于原研药上市几乎不可能,最安全的策略还是先做完BE,等待原研上市后可按4类申报上市。
布立西坦仿制药与改良新药申报情况 |
仿制药方面,布立西坦片剂有2家企业按3类申报:浙江和泽医药申报临床(浙江京新联合申报),目前已经获得临床批准,江西青峰药业申报生产,审评结果是批准临床。
布立西坦注射液只有扬子江药业按3类申报生产,审评结果为未被批准,从浙江和泽申报临床和江西青峰药业申报生产被批准临床的结果可以确定扬子江药业注射液的结果的。
在改良新药方面,越洋医药和上海博志研新都按2.2类新药提交了布立西坦缓释片的临床申请,具体情况如下:
上面是已经提交获得受理的,再来看看哪些企业进行了临床备案:江西青峰比较主动,完成了BE试验后,备案了2个III期临床试验,四川科伦、浙江昂利康制药和浙江京新药业只进行了BE备案,其中浙江京新和浙江昂利康都已经完成了BE试验,四川科伦尚未开展BE 试验:
CTR2021783 | BE | 布立西坦适用于4岁及以上患者的部分发作性癫痫的治疗。 | 进行中 尚未招募 | 四川科伦 | 2021-11-09 |
CTR20210190 | 布立西坦片单臂III期临床试验 | 治疗4岁及以上患者的部分性发作癫痫 | 进行中 (尚未招募) | 江西青峰药业 | 2021-02-02 |
CTR20202213 | BE | 适用于16 岁以上有部分发作性癫痫患者的加用治疗。 | 已完成 | 浙江昂利康制药 | 2020-11-09 |
CTR20202124 | III 期临床试验 | 治疗4岁及以上患者的部分性发作癫痫。 | 进行中 (尚未招募) | 江西青峰药业 | 2020-10-29 |
CTR20192161 | BE | 布瓦西坦片剂和口服溶液适用于治疗4岁以上部分发作性癫痫患者。 | 已完成 | 浙江京新药业 | 2019-10-31 |
CTR20190409 | BE | 癫痫部分性发作辅助治疗 | 已完成 | 江西青峰药业 | 2019-03-08 |
布立西坦基本信息 |
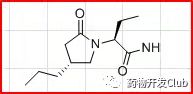
布立西坦是UCB公司开发的第三代抗癫痫药,是自2013年以来FDA批准的首个治疗部分性癫痫发作的抗癫痫药物。与左乙拉西坦具有相同的作用靶点,但是布瓦西坦的亲和力是左乙拉西坦的15-30倍,使其使用剂量降低约10倍。布瓦西坦片剂和口服溶液适用于治疗4岁以上部分发作性癫痫患者。由于布立西坦注射液治疗儿童患者的安全性尚待确定,因此布立西坦注射液仅适用于成年患者(16岁及以上)部分发作性癫痫治疗。
布立西坦片的规格为10mg、25mg、50mg、75mg和100mg,布立西坦注射液的规格为50mg/5ml单剂量小瓶,布立西坦口服液规格为10mg/ml。
布立西坦的用法用量为:当开始治疗,不需要逐渐地剂量递增。推荐起始剂量是50 mg每天2次(100mg每天),根据个体患者耐受性和治疗反应,剂量可能被向下调整至25mg每天2次(50 mg每天)或向上至100 mg每天2次(200 mg每天)。当口服给药是短暂地不可行时,可能使用BRIVIACT注射液。布立西坦注射液应被给予如同布立西坦片和口服溶液相同剂量和相同频数。用布立西坦注射液临床研究经验是限制至4个连续天的治疗。
本文章版权归《药物开发Club》微信公众号所有,如需转载请与版权所有者联系,联系方式微信号L15249406857,同意后方可转载,谢谢配合,文中内容仅供参考!